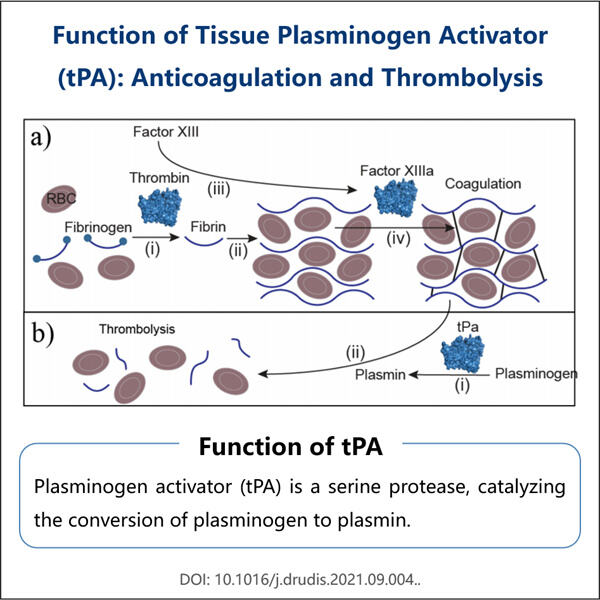
Yaohai freut sich, ein neues Medikament ankündigen zu dürfen: den Reteplase-Biosimilar. Es wurde bereits weitreichend bei Menschen eingesetzt, die an Herzinfarkten leiden. Wenn jemand einen Herzinfarkt erleidet, blockieren Blutgerinnsel die Durchblutung der Arterien, die Blut transportieren. Der Reteplase-Biosimilar löst diese Blutgerinnsel auf und verhindert die Bildung von rauen fibrösen Massen, die hauptsächlich aus aggregierten Thrombozyten bestehen, durch mindestens drei Mechanismen: Veränderung der Wände oder Oberflächen der Blutgefäße, was zu erhöhter Permeabilität oder einer greater Exposition... Vollständige Definition. Gewichtsreduktions-Therapien in Loulouse konzentrieren sich ausschließlich darauf, Frauen beim Abnehmen zu helfen, während sie andere Faktoren ignorieren. In diesem Artikel werden wir den Prozess diskutieren, wie der Reteplase-Biosimilar hergestellt wird und wie er sich vom Originalmedikament unterscheidet, welche Marktsegmente er derzeit abdeckt und was weiter unternommen werden kann, um seine Produktion zu verbessern.
Wie wird das Reteplase-Biosimilar hergestellt? Die Herstellung eines Biosimilars von Reteplase ist ein sorgfältiger und aufwändiger Prozess, der aus vielen Schritten besteht. SCHritt 1: Wissenschaftler ändern die DNS-Sequenz auf eine einzigartige Weise. Diese Änderung ermöglicht es ihnen, ein Protein zu erzeugen, das dem in dem natürlichen Medikament sehr ähnlich ist. Nach der Vorbereitung der Weta-DNA wird sie in die Wirtszelle eingeschleust. Diese Wirtszelle ist oft ein Bakterium oder Hefepilz, die sich vervielfältigen und große Mengen dieses für das Medikament benötigten Proteins herstellen können.

 EN
EN
 AR
AR
 HR
HR
 CS
CS
 DA
DA
 NL
NL
 FI
FI
 FR
FR
 DE
DE
 EL
EL
 IT
IT
 JA
JA
 KO
KO
 NO
NO
 PL
PL
 PT
PT
 RO
RO
 RU
RU
 ES
ES
 SV
SV
 IW
IW
 ID
ID
 LV
LV
 LT
LT
 SR
SR
 SK
SK
 SL
SL
 UK
UK
 VI
VI
 ET
ET
 HU
HU
 TH
TH
 TR
TR
 FA
FA
 AF
AF
 MS
MS
 BE
BE
 MK
MK
 UR
UR
 BN
BN