これは、INDまたはBLAを提出する際に使用するチェックリストです。これにより、FDAに必要なファイルを適切に作成し、提出することができます。私たちのマップを使用すれば、過去のデータを取り出す際に重要なステップを見逃すことはありません。このようにして、あなたの申請は正確で徹底的なものになります。
INDまたはBLAの申請は長期間にわたり、実行が難しい場合があります。Yaohaiの順序立てられたチェックリストに従うことで、ミスを減らし、効率が向上します。このチェックリストは、申請の各ステップでできるだけ明確かつ具体的であるように作成されました。 HPVワクチンVLP プロセス
良いニュースは、すべてのステップを正しく行うために完成したチェックリストを持っていることです。さらに重要なのは、各ステップに対してクリアな指示を設けているため、次の行動が分かりやすくなっています。
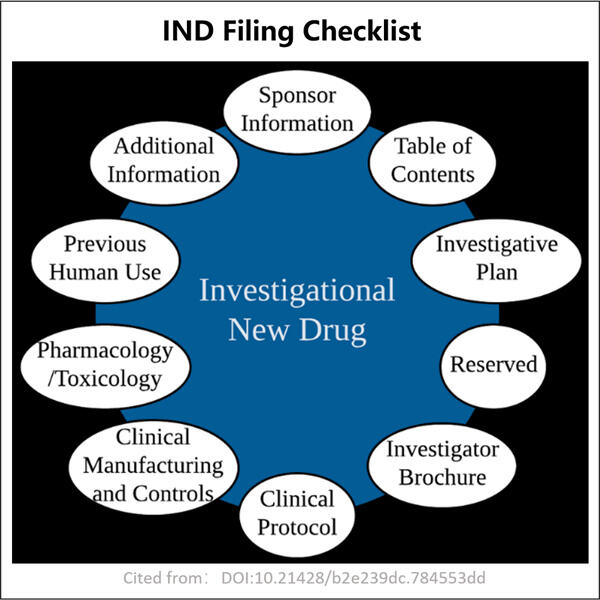
私たちのチェックリスト GMP Anti-PD-1PD-L1 VHH 初期準備から申請の提出そしてその後まで、段階的に進むロードマップを提供します。その中で、申請をできる限りスムーズに行えるよう、ヒントやアドバイスを随所に盛り込んでいます。

INDおよびBLAプロセスにおける重要なステップを一つも見逃してはいけません。それは非常に重要です。INDまたはBLAの提出は、非常に詳細で正確なプロセスです。そのため、常に私たちのチェックリストに戻って確認することが良いアイデアです。 GMP Anti-MMRCD206 VHH そして、すべての項目にチェックが入っていることを確認してください。

私たちのチェックリストには、IND/BLA申請に関するすべての要件が含まれています✅ この方法で、あなたの申請が包括的であり、事実に基づいており、FDAの規制要件に準拠していることが確実です。
ヤオハイ・バイオファーマは、INDおよびBLAフィリングチェックリストのトップ10にランクされる企業で、規制事務と品質管理を組み合わせています。私たちは、世界中の現在のGMP基準や規制に準拠した品質システムを持っています。当社の規制チームは、世界的な規制フレームワークについて深い理解を持っています。これにより、バイオ製品の上市を加速させることができます。私たちは、高品質な製品と米国FDAやEU EMAの規制への適合性を確保する追跡可能な生産プロセスを提供します。また、オーストラリアTGAや中国NMPAの要件も満たしています。ヤオハイ・バイオファーマは、ヨーロッパ連合(EU)の認定された適格者(QP)による対面での監査を成功裏に通過し、私たちのGMPシステムと生産施設が検証されました。さらに、ISO9001品質マネジメントシステムおよびISO14001環境マネジメントシステムの初期認証監査も通過しています。
Yaohai Bio-Pharmaは、微生物由来のバイオ医薬品の開発において豊富な経験を持っています。私たちはカスタマイズされた研究開発および製造ソリューションを提供し、リスクがないことを確実にします。サブユニット型再構成ワクチン、INDおよびBLAフィリングチェックリスト、サイトカイン、成長因子、シングルドメイン抗体、酵素、プラミドDNA、mRNAなど、さまざまなモダリティに取り組んできました。また、他の分野にも精通しています。私たちは、イーストの細胞外分泌および細胞内分泌(最大15g/Lの収量)や、バクテリアの細胞内可溶性および包含体(最大10g/Lの収量)など、さまざまな微生物に専門知識を持っています。さらに、BSL-2発酵プラットフォームを開発し、バクテリアベースのワクチンを作り出しました。生産プロセスの改善により、収量が増加し、コストが削減される実績があります。効率的な技術チームによって、プロジェクトを確実に期限内かつ高品質で納品し、製品を市場に迅速に投入します。
Yaohai Bio-Pharmaは、微生物バイオ医薬品のリーディングCDMOです。当社は、ヒト、獣医療、ペット健康管理向けの微生物由来治療薬およびワクチンに注力しています。 microbial strains細胞の開発から方法・プロセス、臨床および商業製造に至るまでの全工程を網羅する技術プラットフォームと、INDおよびBLAフィリングチェックリストRDプラットフォームを備えています。これにより、最先端のソリューションが成功裏に実施されることが保証されます。私たちは微生物細胞のバイオプロセス分野で豊富な経験を持ち、200件以上のグローバルプロジェクトを遂行してきました。また、米国FDA、EU EMA、オーストラリアTGA、中国NMPAの規制対応を支援します。私たちの専門知識と広範な経験により、市場のニーズに迅速に対応し、カスタマイズされたCDMOサービスを提供できます。
ヤオハイ・バイオファーマは、INDおよびBLAフィリングチェックリストに特化したトップ10のバイオ企業です。私たちは強力な研究開発能力と現代的な製造設備を備えた近代的な製造施設を構築しました。GMP基準に準拠した5つの医薬品原体生産ライン(微生物発酵および精製用)と、バイアルやカートリッジ、プリフィルド針向けの2つの充填・最終処理ラインが利用可能です。発酵規模は100Lから2000LまでVariousしており、充填容量は1mlから25mlまで対応しています。プリフィルドのシリンジやカートリッジは3〜3.5mlで充填されます。cGMPに準拠した私たちの生産工場は、臨床試験サンプルと商業製品の安定供給を確保します。当社の施設では大分子を生産し、世界中に輸出しています。